分子の形や結合次数を調べたり、有機化学反応の電子の流れを考える際、ルイス構造式がよく用いられます。
このルイス構造式によると水分子は同じ孤立電子対を2組持ちますが、実はX線の実験によるとこの描写は正しくありません。
ルイス構造式はあくまで概念図であるため、分子の光吸収や反応は量子化学に基づいて考察する必要があります。このページでは量子化学計算から得られる水分子$\text{H}_2\text{O}$の孤立電子対や共有結合の描写を紹介します。
ルイス構造式はあくまでも概念の図
早速ですが、水分子$\text{H}_2\text{O}$はルイス構造を描くと2つの対等な不対電子対(孤立電子対)を持ちます。

この非共有電子対は水が関与する化学反応においてとても重要な役割を果たしています。例えば、エステルの分解反応では、水の不対電子対によるエステルへの求核負荷が非常に重要な役割を果たします。

しかし、ルイス構造式とは異なり、量子化学計算(RHF法)を行った場合、2組の対等な不対電子対の軌道は得られません。さらに、O-H結合についても結論が異なります。
| 量子化学計算(RHF法) | ルイス構造式 | |
| 孤立電子対 | 1つの軌道のみ | 2組存在 |
| O-H結合 | $\text{H}_2\text{O}$全体に広がる軌道が3つ | 厳格に2本 |
結論を先に述べると、ルイス構造式はSchrodinger方程式よりも前に提唱されたもので、化学結合の次数などをイメージする上ではとても有用ですが、あくまでルイス構造式は概念図であることに注意する必要があります。

例えばルイス構造式によるNaClは単結合になるけど、実際には格子状のイオン結合だよね。

実験結果は量子化学計算から得られる結論を支持することが多い(ほとんど)です。
次からはこれらの違いについて、解説していきます。
水分子の孤立電子対は1組?2組?
反応する非共有電子対は酸素のp軌道
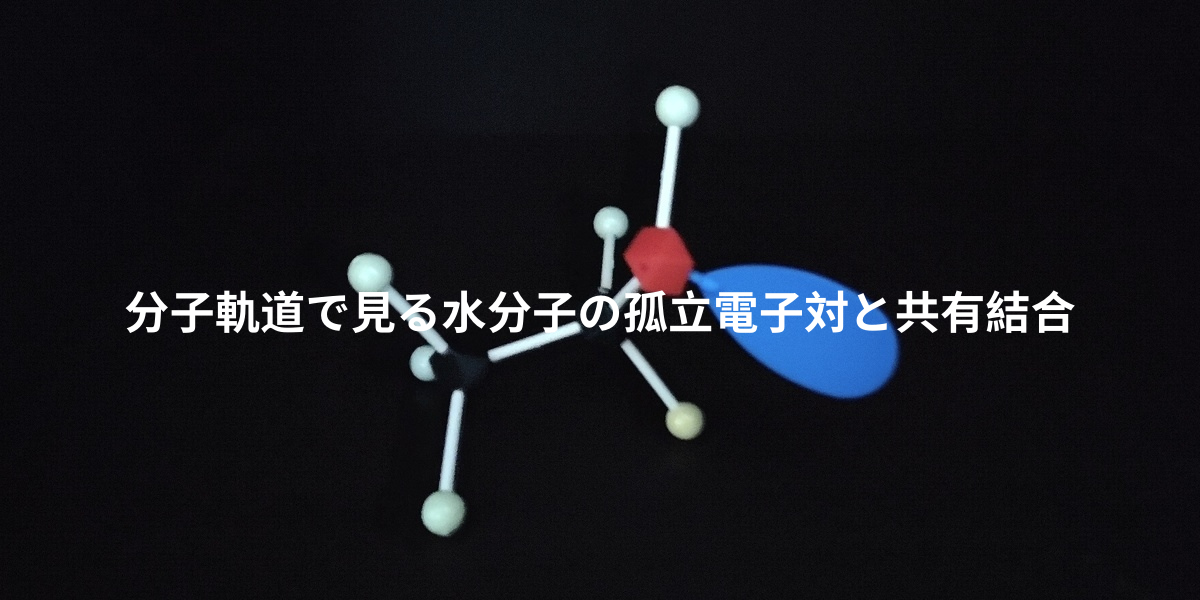
水分子で重要な非共有電子対はHOMO軌道(電子が占有する軌道のうちでもっともエネルギーが高い軌道)$\phi$です。量子化学計算によると、酸素原子のp軌道だけから構成されていることがわかります(pz軌道とします)。

酸素原子Oのpz軌道は水素原子Hがもつ1s軌道と相互作用しない(対称性から重なり積分などが積分すると$0$になる)ため、酸素原子Oのpz軌道をもとにした分子軌道は水素原子の原子軌道と混ざり合わず、局在化したまま分子軌道になります。
さらに、このHOMOはエネルギー準位が$-13.9\text{eV}$($-15\text{eV}$より高い)であるため、電子供与体として働きます。これが水分子の孤立電子対が求核性を示す理由です。

おおよそ$-15\text{eV}$よりも高いエネルギー準位の電子は電子供与体として働けます。
もうひとつの非共有電子対は?
水分子が持つもう一つの非共有電子対を考えましょう。水分子はルイス構造を描くと、2つの非共有電子対を持ちます。この2つはルイス構造では対等に見えます。

しかし、量子化学計算を行ってみると、もう一つの非共有電子対とされる軌道$\psi$は先ほどのHOMO軌道$\phi$とは異なり、酸素原子の原子軌道だけで構成されず、水素原子の影響を受けます。

具体的には、$\psi=-0.4\chi_{\text{O2s}}-0.88\chi_{\text{O2py}}$$+0.14\chi_{\text{H1}}+0.14\chi_{\text{H2}}$になります。

「水素原子の影響を受けてる」ってことは非共有電子対ではないよね

ルイス構造式と違い、量子化学計算から得られる不対電子対はHOMO軌道$\phi$の1つだけです。軌道$\psi$は$\text{O}$原子軌道だけで構成されないため、厳格には不対電子対の軌道とは言えません。

ルイス構造式と量子化学計算の結論が異なることは多々あります。
では、ルイス構造式と量子化学計算の結果のどちらを信じればよいのでしょうか?もちろん、実験の結果(分子の光吸収、発光や反応性など)は量子化学計算の結論を支持することが多い(ほとんど)です。
実際、水分子についてもX線発光の実験データは量子化学計算によるエネルギー準位の結果を支持する結果が得られています(Electrochemistry, 82(9), 756–761 (2014))。
O-H結合は2本?3本?
水分子のO-H結合を担う分子軌道も確認しておきましょう。
量子化学計算から得られる軌道エネルギー$-39.4\text{eV}$と$-20.8\text{eV}$の2つの軌道が酸素原子と水素原子の間での電子密度が高いため、2つのO-H結合を担う分子軌道と考えられます。
O-H結合の2本は対等であるため、縮退した(軌道エネルギーが同じ)軌道が得られるかと思いきや、量子化学計算の結果からは縮退した軌道は得られません。そのため、量子化学計算からは、(先ほど紹介した非共有電子対とされる軌道$\psi$と合わせて)$\text{H}_2\text{O}$全体に広がった3つの軌道によって水分子の結合が維持されているという結論が得られます。


水素と酸素の混ざり合いが弱い軌道を非結合性軌道とすればO-H軌道の数と合いますが、恣意性が入ります。
まとめ
このページでは、水分子における量子化学計算の結果をもとに、孤立電子対やO-H結合を担う分子軌道について解説しました。
ルイス構造式では水分子は2つの孤立電子対と2つのO-H結合をもち、それぞれそれらは対等に描かれます。しかし、量子化学計算の結果からは孤立電子対の軌道は1つだけで、厳格なO-H結合の軌道はなく、$\text{H}_2\text{O}$全体に分布する3つの分子軌道があることがわかりました。
ルイス構造式は概念図であることに注意し、分子の光吸収、発光や反応性を扱う際は量子化学に基づいて考察する必要があります。