フントの規則とは「スピンは可能な限り平行にして軌道に入る」というもので、古典力学などでは説明できない量子論的な効果です。
例えば、フントの規則によって酸素は3重項状態なので、磁性を持っていたり、スピン禁制により反応性が抑制されています。(もし酸素が1重項であれば、我々の生体酸化反応はもっと早かったかもしれません。)
このように、私たちは身近な酸素から量子効果を感じることができるのです。量子効果は縁遠くありません。このページで、電子が様々なスピン状態で軌道に入るときのエネルギーを考えていきましょう。
- 電子間の反発エネルギーがスピン状態で変わることを紹介します。
- 酸素分子が磁性を持つ理由を説明します
- クーロン積分、交換積分がなぜ量子化学で出てくるか紹介します。
電子間反発エネルギーはスピン状態で変化する
事前準備:1つの電子が軌道に入るとき
「フントの規則」は電子が2つ以上ある場合の規則ですが、まずは事前準備として、1つの電子が分子軌道に入ったときのエネルギーを考えます。
エネルギー準位$h_1$に電子が1つ入ったときのエネルギーは$h_1$です。エネルギー準位$h_2$に電子が入ったときはもちろん$h_2$です。


ここまではとてもシンプルだね
2つの軌道にそれぞれ電子が入るとき
では、エネルギー準位$h_1$と$h_2$の軌道に電子が1つずつ入ったときのエネルギーはいくつでしょうか?電子1つの時との違い、電子間反発を考える必要があります。

この電子間反発が「フントの規則」の源泉です。
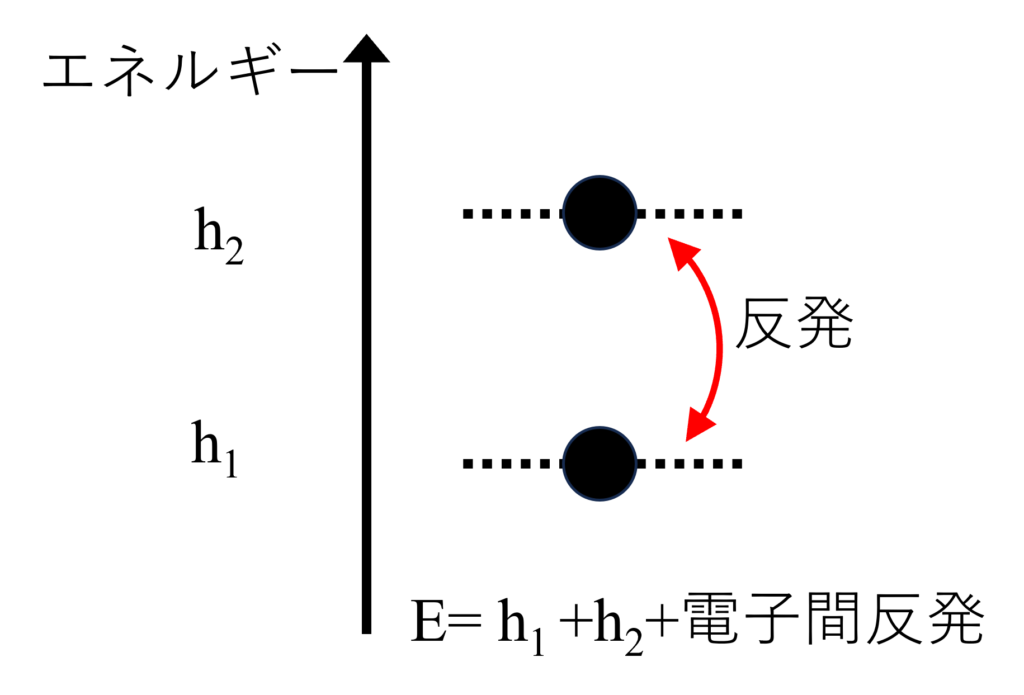
ここで、ポイントは電子が$\alpha$スピンとして軌道に入る場合と$\beta$スピンとして入る2つの場合があるということです。このスピンというものは量子効果で出てくるもので、電子がもつ自由度の一つです。

$\alpha$、$\beta$スピンって止まっているの?

スピンの軸方向を決めると、不確定性原理から電子スピンの角運動量はその軸の周りに回転します。
$\alpha$スピンと$\beta$スピンとして2つの軌道に電子が入る場合、エネルギーは$E(\uparrow\downarrow)=h_1+h_2+J_{12}$と表すことができます。$J_{12}$はクーロン積分と呼ばれるもので、電子がマイナス電荷を持っていることによるクーロン反発を表します。
一方、$\alpha$スピンが2つずつ入る場合、$\alpha$スピンと$\beta$スピンが入るときよりもエネルギーは低下し、$E(\uparrow\uparrow)=h_1+h_2+J_{12}-K_{12}$となります(具体的な計算はページ末尾で説明)。この$K$は交換積分と呼ばれるもので、量子効果から発生するものです。


なぜ$E(\uparrow\uparrow)$はエネルギーが下がるの?奇妙じゃない?

$E(\uparrow\downarrow)$と$E(\uparrow\uparrow)$の違いは量子的なもので、古典的イメージは与えにくいです。

$E(\uparrow\downarrow)$と$E(\uparrow\uparrow)$の具体的な計算はこのページの末尾で説明します
例えば、$1.4\unicode{xC5}$だけ離れた2つの水素原子に1つずつ電子が入ったとき、クーロン積分$J_{12}$は$15eV$、交換積分$K_{12}$は$8.5eV$程度の値を持ちます。そのため、$E(\uparrow\downarrow)$は$15eV$ですが、$E(\uparrow\downarrow)$は$15-8.5=6.5eV$とエネルギーが下がります。
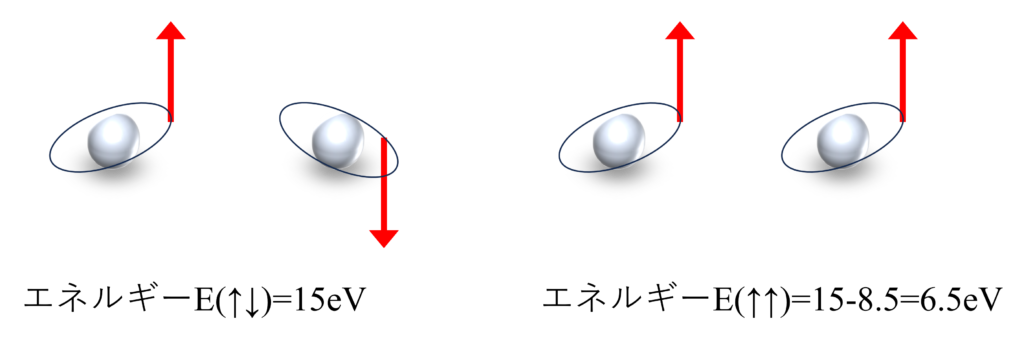

$E(\uparrow\uparrow)$の方が$K_{12}$の分だけエネルギーが下がります。
フントの規則_酸素が磁性を持つ理由
先ほどの結果から、$E(\uparrow\uparrow)$は$E(\uparrow\downarrow)$よりも低エネルギーになることを紹介しました。
これは「フントの規則」として知られており、電子は可能であればスピンを平行状態にして軌道に入ります。これが発現する有名な例は酸素の磁性です。

液体窒素で液体酸素を作り、ネオジウム磁石を近づけると液体の酸素が引き寄せられるよ。

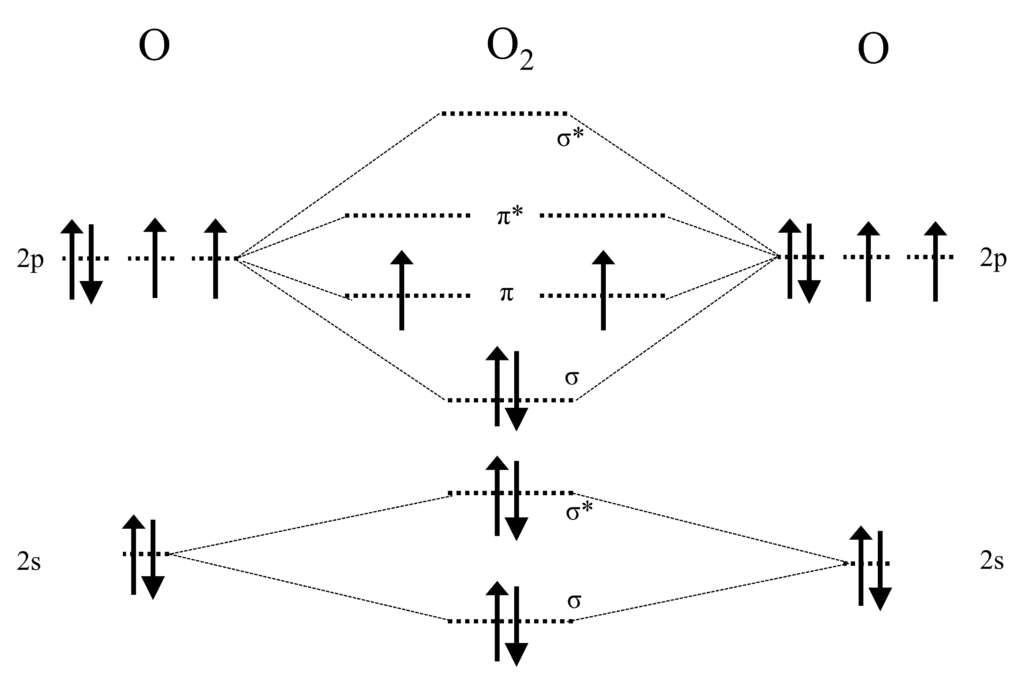
つまり、酸素分子は磁性を示しますが、これは分子軌道
によって説明ができます。
酸素には同エネルギーの$\pi$軌道が2つあり、そこに電子が2つ入ります。酸素分子ではフントの規則がそのまま当てはめることができ、エネルギーを下げるためにスピン状態を平行にして電子が入ります。そのため、スピンによる磁性が残り、酸素分子は磁性を持ちます。
発展:軌道エネルギー準位が異なる場合
「フントの規則」によると、分子軌道に対してスピンは可能な限り平行に入ります。この、「可能な限り」とはどう意味でしょうか?
結論を述べると、「電子スピンを平行にするか、反平行にして分子軌道を閉殻にするかは、分子軌道のエネルギー準位差による」という意味です。
エネルギー準位が異なる2つの軌道$h_1$と$h_2$に2つの電子が入る場合のエネルギーを考えましょう。
反平行にして軌道を閉殻にした場合、エネルギーは$E_1=2h_{1}+J_{11}$です。一方、スピンを平行にした場合は$E_2=h_1+h_2+J_{12}-K_{12}$です。
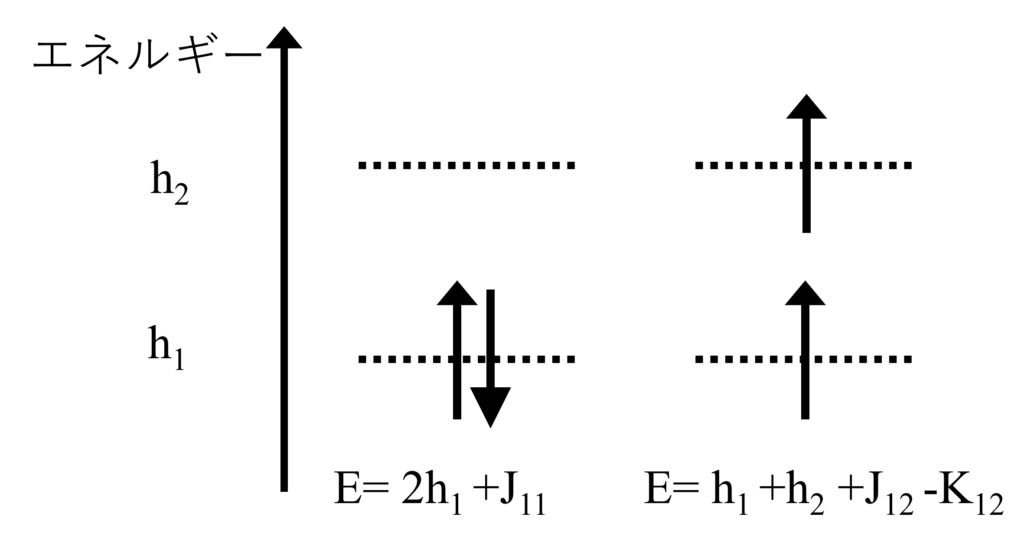
つまり、$h_1$と$h_2$のエネルギー準位差が小さい場合は、$K_{12}$によるマイナス効果が大きくなり、スピンは平行状態で$h_1$と$h_2$の軌道に電子が1つずつ入ります。一方で、$h_1$と$h_2$のエネルギー準位差が大きい場合はスピンを反平行状態にしてでも低エネルギー準位の軌道に電子が2つ入ります。フントの規則が当てはまるかは軌道のエネルギー差次第です。
一般の分子において電子は軌道に2つずつ入るのが基本ですが、これは軌道のエネルギー準位差が大きいためです。例えば、水素分子のHOMOは$-33eV$、LUMOは$-12eV$と$20eV$くらいの差がありますが、この2つの軌道に$\alpha$スピンが1つずつ入ったときの安定化は$5eV$程度と軌道エネルギー差に比べると小さいです。

分子軌道間のエネルギー差が大きいから、分子の多くは磁性を持たないんだね。
一方で、金属錯体では、HOMO周辺のエネルギー準位差が小さいので、交換積分$K$との競合が起きます。その結果、同じ金属種でも配位子によってスピンを平行にするか、あるいは、軌道を閉殻にするかが変化します。
クーロン積分と交換積分の出所について
クーロン積分$J$と交換積分$K$がなぜ量子化学で登場するか、Slater行列式を使って調べましょう。
α、βスピンとして2つの軌道入った場合
この場合、電子状態は$\ket{\phi_1(r)^\alpha,\psi_2(r^\prime)^\beta}$になり、反発エネルギー$E_{\uparrow\downarrow}$は$\Braket{\phi_1(r)^\alpha,\psi_2(r^\prime)^\beta | \frac{1}{r-r^\prime} | \phi_1(r)^\alpha,\psi_2(r^\prime)^\beta}$で計算できます。
$\ket{\phi(r_1)^\alpha,\psi(r_2)^\beta}$はSlater行列で表さているので、具体的には$\frac{\phi(r_1)\alpha(1)\psi(r_2)\beta(2)-\psi(r_1)\beta(1)\psi(r_2)\alpha(2)}{\sqrt{2}}$です。
つまり、$E_{\uparrow\downarrow}$は次のように計算できます。$E_{\uparrow\downarrow}=\frac{1}{2}\int\phi^\ast(r_1)\psi^\ast(r_2)\frac{1}{r_{12}}\phi(r_1)\psi(r_2)$$\int\alpha^\ast(1)\beta^\ast(2)\alpha(1)\beta(2)$$-\frac{1}{2}\int\phi^\ast(r_1)\psi^\ast(r_2)\frac{1}{r_{12}}\phi(r_1)\psi(r_2)$$\int\alpha^\ast(1)\beta^\ast(2)\beta(1)\alpha(2)+\cdots$$=\int\phi^\ast(r_1)\psi^\ast(r_2)\frac{1}{r_{12}}\phi(r_1)\psi(r_2)$
($\frac{1}{r-r^\prime} =\frac{1}{r_{12}}$と簡略化して書いています)

なんでこんなにすっきりするの?

スピン部分の積分で$\int\alpha^\ast(1)\beta(1)=0$や$\int\beta^\ast(2)\alpha(2)=0$などと直交性を利用できるからだよ
結果として、$\int\phi^\ast(r_1)\psi^\ast(r_2)\frac{1}{r_{12}}\phi(r_1)\psi(r_2)=J$とすると、$E_{\uparrow\downarrow}=J$と書けます。
2つのαスピンが2つの軌道に入った場合
この場合、電子状態は$\ket{\phi_1(r)^\alpha,\phi_2(r^\prime)^\alpha}$になります。$E_{\uparrow\downarrow}$と同じように$E_{\uparrow\uparrow}$を計算していきましょう。
$\ket{\phi(r_1)^\alpha,\psi(r_2)^\alpha}$もSlater行列で表されるので、具体的には$\frac{\phi(r_1)\alpha(1)\psi(r_2)\alpha(2)-\psi(r_1)\alpha(1)\psi(r_2)\alpha(2)}{\sqrt{2}}$です。
$E_{\uparrow\uparrow}$$=\frac{1}{2}\int\phi^\ast(r_1)\psi^\ast(r_2)\frac{1}{r_{12}}\phi(r_1)\psi(r_2)$$\int\alpha^\ast(1)\alpha^\ast(2)\alpha(1)\alpha(2)$$-\frac{1}{2}\int\phi^\ast(r_1)\psi^\ast(r_2)\frac{1}{r_{12}}\phi(r_1)\psi(r_2)$$\int\alpha^\ast(1)\alpha^\ast(2)\alpha(1)\alpha(2)+\cdots$$=\int\phi^\ast(r_1)\psi^\ast(r_2)\frac{1}{r_{12}}\phi(r_1)\psi(r_2)$-$\int\phi^\ast(r_1)\psi^\ast(r_2)\frac{1}{r_{12}}\psi(r_1)\phi(r_2)$
結果として、$\int\phi^\ast(r_1)\psi^\ast(r_2)\frac{1}{r_{12}}\psi(r_1)\phi(r_2)=K$とすると、$E_{\uparrow\uparrow}=J-K$と書けます。

計算的には$\int\alpha^\ast(1)\beta(1)=0$みたいな直交するスピン積分がないから$K$が残るんだね。
つまり、スピンは平行の方がエネルギーは小さくなります。

この交換積分は$K\ge0$であることも証明されています。
まとめ
化学者にとって、物質の反応性や物性を知るためには、分子の電子状態を考えなければなりません。電子状態が全体のエネルギーに与える影響はかなり大きいためです。
電子状態のエネルギーは軌道エネルギーと電子間反発による効果でおおむね説明することができます。特に金属錯体では、スピンを平行にして入るのか、反平行にして軌道を閉殻にするのかは容易に変化するので、量子化学計算を行う際は注意しましょう。